

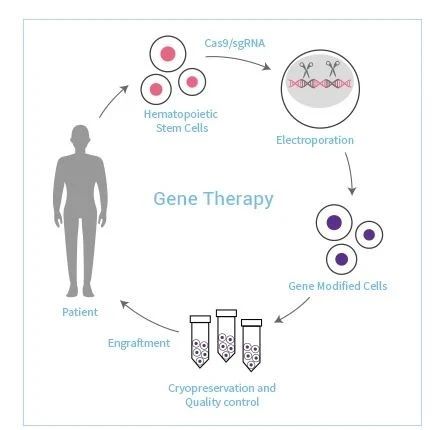
基因治療是指將外源正常基因導入靶細胞,以糾正或補償缺陷和異常基因引起的疾病,達到治療目的。基因治療的爆發起源于20世紀90年代初,隨著人類對基因治療的認識不斷加深,基因療法也愈來愈成熟,經過三十幾年科學技術的發展,全球的基因治療行業已經大步邁向成長期,在某些適應證上基因治療已經比傳統的治療方案更加有優勢。
2019年5月,全球首個治療輸血依賴型β地中海貧血(TDT)的基因療法Zynteglo(LentiGlobin,bb1111,含βA-T87Q珠蛋白編碼基因的自體CD34+細胞)獲得歐洲藥品管理局(EMA)有條件批準,其研發公司為藍鳥生物公司(bluebird bio)。Zynteglo是一種一次性基因療法,開發用于治療β 地中海貧血和鐮狀細胞病(SCD)。2020年9月,EMA已授予Zynteglo治療SCD的優先藥物資格(PRIME),此前,EMA還授予了Zynteglo治療SCD的孤兒藥資格(ODD);在美國,FDA授予了Zynteglo治療SCD的ODD、快速通道資格(FTD)、再生醫學先進療法資格(RMAT)、罕見兒科疾病資格(RPDD)。
目前,LentiGlobin基因療法用于治療SCD正處于臨床研究階段,臨床開發計劃包括已完成的1/2期HGB-205研究、正在進行的1/2 期(HGB-206)和3期(HGB-210)臨床研究。但這個適應癥的開發過程就沒有β 地中海貧血那么順利,2021年2月16日,藍鳥生物宣布停止基因療法LentiGlobin治療SCD的1/2期和3期臨床研究,原因是參加其基因療法LentiGlobin1/2 期(HGB-206)臨床試驗的SCD患者中分別出現一例患急性髓細胞白血病(AML)和一例骨髓細胞異常增生癥(MDS)。2月23日,FDA發布公告稱將藍鳥公司治療SCD的LentiGlobin基因治療臨床試驗方案擱置。在經過FDA近一月的審查后,藍鳥生物宣布,其LentiGlobin基因療法是“極不可能(very unlikely)”導致接受治療的鐮狀細胞病患者出現AML的,數據證明LentiGlobin基因療法并不會使患者出現異常綜合征,藍鳥生物現在正與FDA談判計劃恢復臨床試驗。
無獨有偶,在2020年8月時,FDA也拒絕過BioMarin的治療A型血友病的基因療法BMN270,因懷疑血友病患者接受基因治療不能終身受益,要求BioMarin提供所有研究參與者的兩年隨訪安全性和有效性數據;此后,不到半年的時間,UniQure的一項針對B型血友病的基因療法也被美國FDA叫停,起因是一位志愿者患肝癌。針對這些問題,BioMarin 仍然希望其療法獲得批準;UniQure 認為癌癥病例不太可能與治療相關,臨床試驗也在繼續進行中。
這一次的烏龍事件也只是讓大家虛驚一場,基因治療手段仍然被寄予厚望,Zynteglo的獲批是一個好的開始,國內外藥企對于血液疾病的基因治療持續布局,下一個上市的基因治療藥物能否花落血液疾病領域,也讓我們拭目以待。
血友病(Hemophilia)是一種X染色體連鎖的隱性遺傳性出血性疾病,可分為血友病A(血友病甲,缺乏凝血因子Ⅷ,患病人數約占80%~85%)、血友病B(血友病乙,缺乏凝血因子Ⅸ,患病人數約占15%~20%)和血友病C(血友病丙,缺乏凝血因子Ⅺ,罕見)。患者因凝血因子基因缺陷導致凝血功能障礙,終身具有輕微創傷后出血傾向,重癥患者沒有明顯外傷也可發生“自發性”出血。血友病患者自出生時即可發病,伴隨終身,如果得不到標準規范的治療,致殘及致死率很高。
目前臨床上治療血友病常規方案是替代治療,即給患者補充所缺乏的凝血因子,但這種方案存在缺陷,如凝血因子在體內半衰期短,需反復注射等,不能治愈,需要終身治療,但仍有出血風險,這不僅影響患者的正常生活,且治療費用昂貴,給患者帶來很大的經濟負擔。已上市的凝血因子代表產品如:Baxalta的Advate/Recombinate,諾和諾德的Novoseven,拜耳公司的KogenateFS等。Biogen的長效凝血因子Alprolix和Eloctate、拜耳的重組長效凝血因子 Kovaltry 也相繼獲批上市,長效凝血因子藥物的市場和地位不斷拓展和鞏固。
近年來,市面上也出現了治療血友病的創新藥,如羅氏的Hemlibraa(Emicizumab,艾美賽珠單抗)是血友病藥物研發20年來首個獲得FDA批準的用于治療A型血友病的新藥。根據2019年羅氏財報,Hemlibra年銷售額達13.8億瑞士法郎,增長超500%,Hemlibra需每周皮下注射一次,按照羅氏的定價,患者需要承擔第一年48.2萬美元、此后44.8萬美元/年的用藥成本。
基因療法對血友病的治療提供了“一勞永逸”的新思路,傳統藥物及像Hemlibra等新型抗體藥物將直面基因療法的沖擊。早在1991年,我國科學家就進行了世界上首例血友病B的基因治療臨床試驗。現階段多個基因治療臨床試驗已經表現出了良好的療效與進展,如BioMarin公司的A型血友病基因療法BMN 270已于近期提交了BLA申請,Sangamo/輝瑞的SB-525也處于III期臨床階段,血友病的用藥市場格局即將被基因療法所改變。
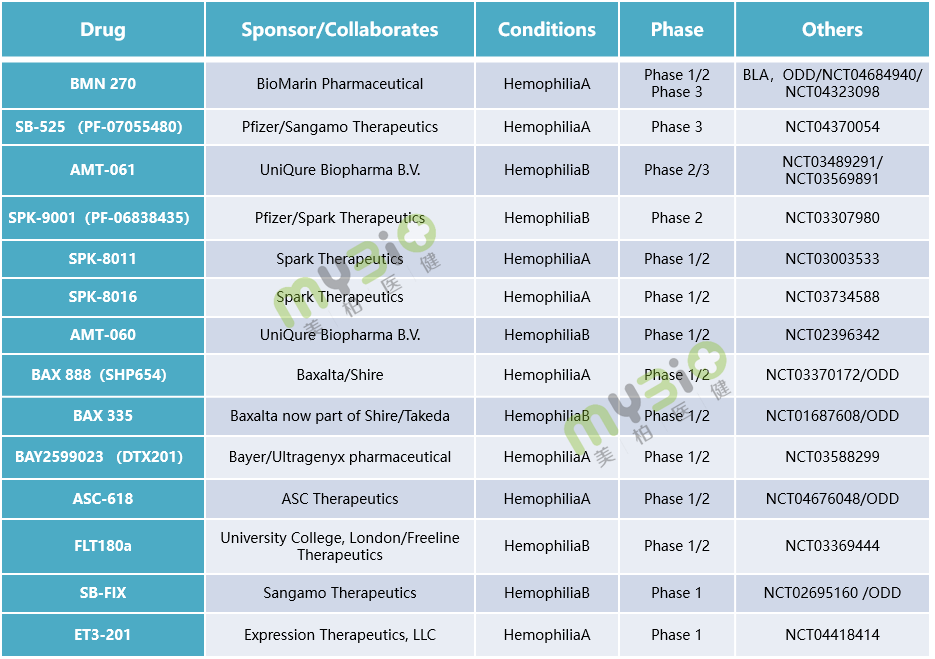
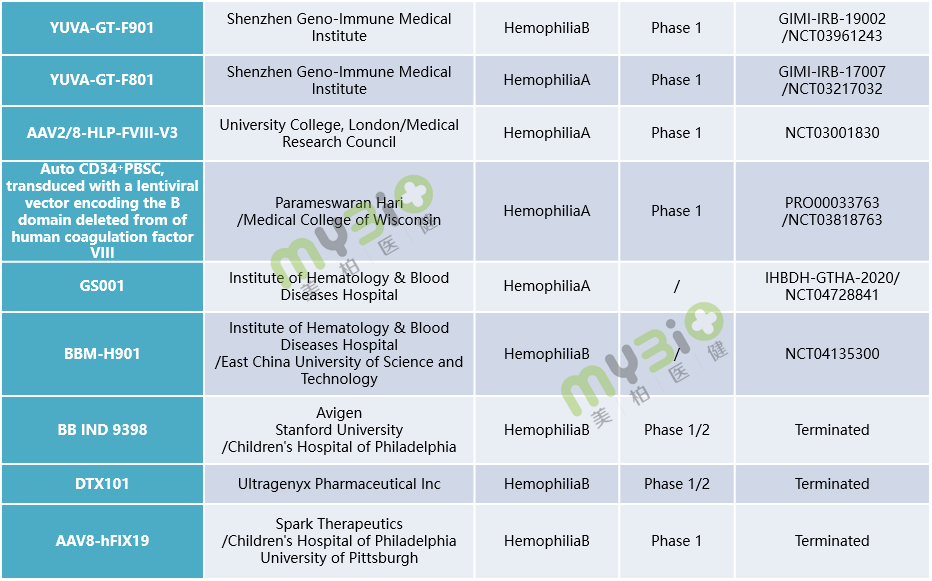 ▲表1 處于臨床階段的部分血友病基因治療候選療法
▲表1 處于臨床階段的部分血友病基因治療候選療法
血友病基因治療的主要模式為載體介導和細胞介導。載體介導即利用載體將目的基因轉入靶細胞,使其在靶細胞中表達。細胞介導即提取患者細胞并利用ZFN、TALEN或CRISPR/Cas9等基因編輯技術進行基因改造,擴增后移植入患者體內。基因治療可以使血友病患者體內自行表達FVIII或FIX,甚至可達正常水平,這使之成為“一次性”治愈血友病的唯一手段。
研發基因療法用于治療血友病的代表公司:
BioMarin創立于1996年,總部位于美國,是一家針對慢性基因性疾病研發的公司。
BioMarin的候選產品BMN 270正在進行3期臨床試驗,已經獲得美國FDA授予的孤兒藥和突破性療法認定,也已獲得而歐盟PRIME資格。其生物制品許可申請(BLA)已被FDA受理,優先審核用于治療嚴重A型血友病患者,這是美國第一個針對血友病的基因治療產品,也是有望成為第一個被批準用于治療A型血友病患者的基因療法。
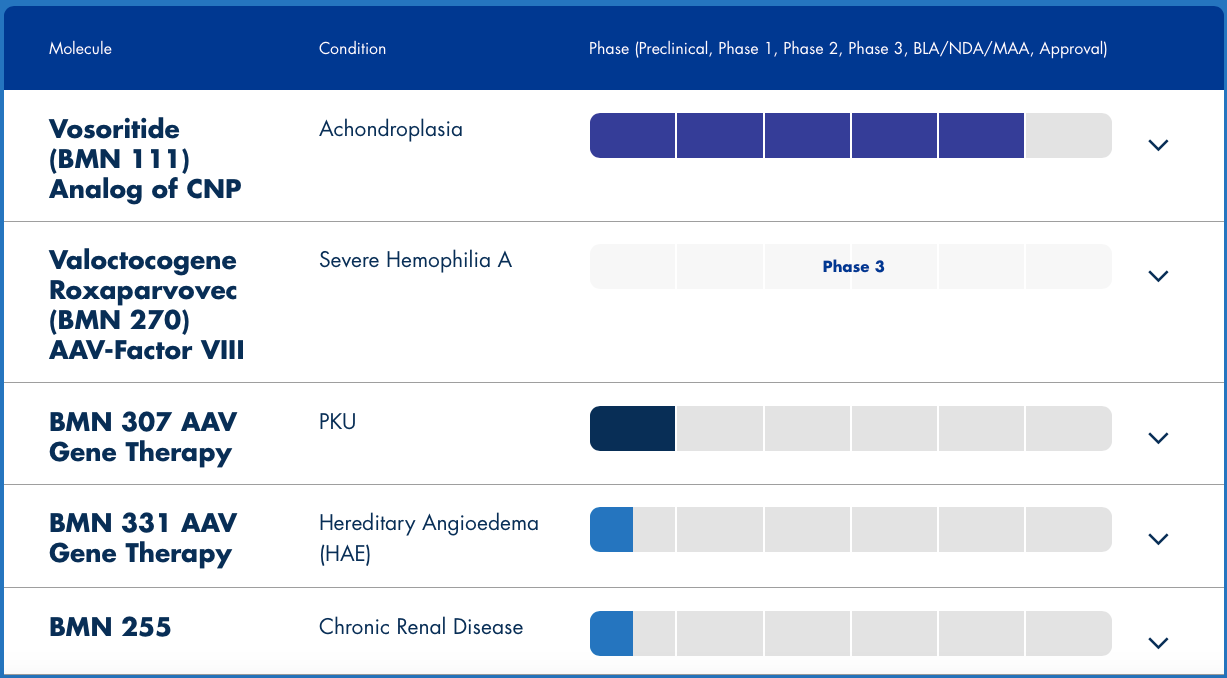 ▲圖片來源:BioMarin官方網站
▲圖片來源:BioMarin官方網站
Spark成立于2013年,總部位于賓夕法尼亞,是一家專注于遺傳疾病基因治療產品開發的公司,2019年12月,羅氏以48億美金的價格完成對Spark的收購。
Spark最初是研究罕見病特效孤兒藥的公司,2017年年底,其針對罕見眼科疾病的基因療法Luxturna獲FDA批準,成為首個在美國上市的基因療法。其兩款治療血友病的明星產品SPK-9001和SPK-8011在臨床上也表現出很好的療效,此外,另一款基于AAV載體表達凝血因子VIII的基因療法SPK-8016也處于臨床階段。
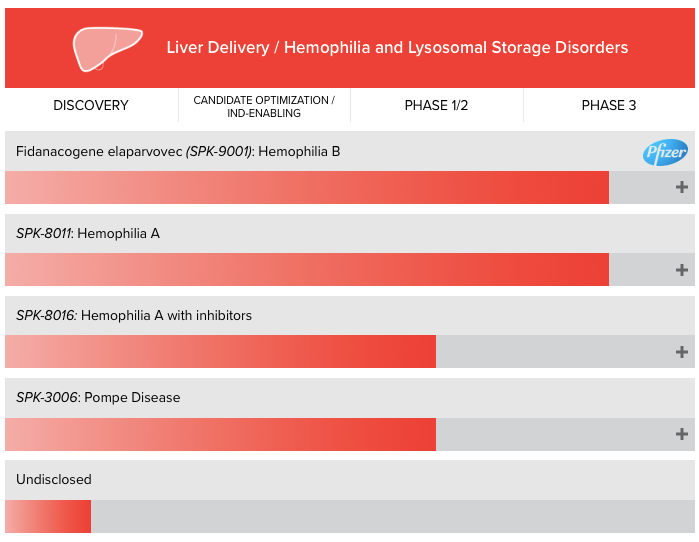 ▲圖片來源:Spark官方網站
▲圖片來源:Spark官方網站
UniQure創立于1998年,總部位于荷蘭,是一家從事基因治療藥物開發的生物制藥公司。UniQure擁有歐洲上市的首個基因療法Glybera,用于治療脂蛋白脂酶缺乏癥(LPLD)。
2020年6月,UniQure宣布與CSL Behring簽訂許可協議, CSLBehring獲得UniQure在B型血友病適應癥上的的基因治療產品AMT-061的全球獨家權利,總交易額超20億美元。
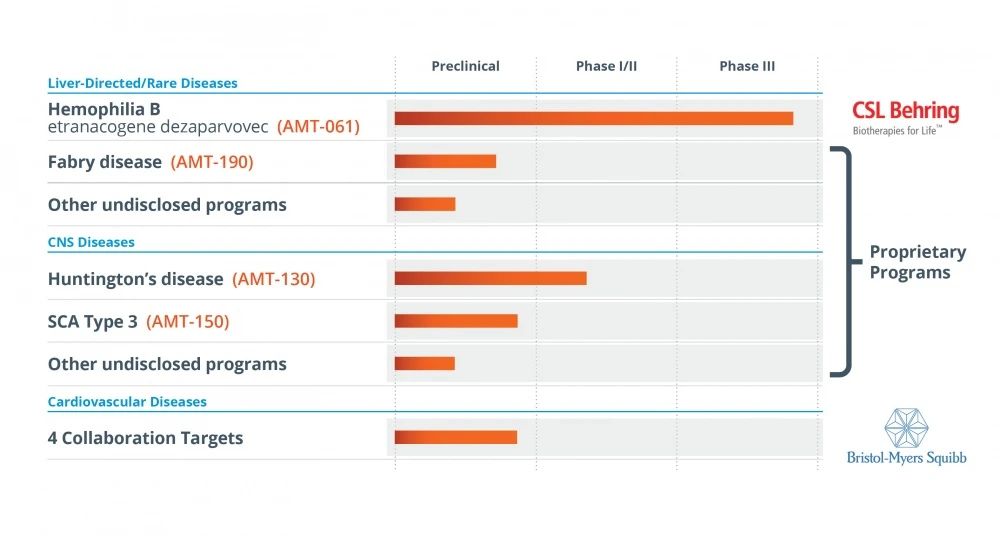 ▲圖片來源:UniQure官方網站
▲圖片來源:UniQure官方網站
Sangamo創立于1995年,總部位于美國,是一家專注于基因編輯、基因治療和細胞治療平臺技術的生物制藥公司。Sangamo在ZFN基因編輯技術上深耕20余年,ZFN技術相關的專利基本由該公司持有,獲得包括鋅指蛋白設計、篩選、優化、實驗室及臨床應用等多項專利。
2017年5月,Sangamo與Pfizer就一款A型血友病基因療法SB-525,簽署了全球獨家合作和許可協議,交易金額達5.45億美元。目前,FDA已授予SB-525孤兒藥地位和快速通道認定。此外,2018年12月,Sangamo宣布1/2期臨床試驗評估SB-FIX的第一位患者進行治療,這是全球首個利用鋅指核酸酶(ZFN)技術并且針對B型血友病的在體基因編輯臨床試驗,且該療法在2016年便獲FDA授予的孤兒藥資格。
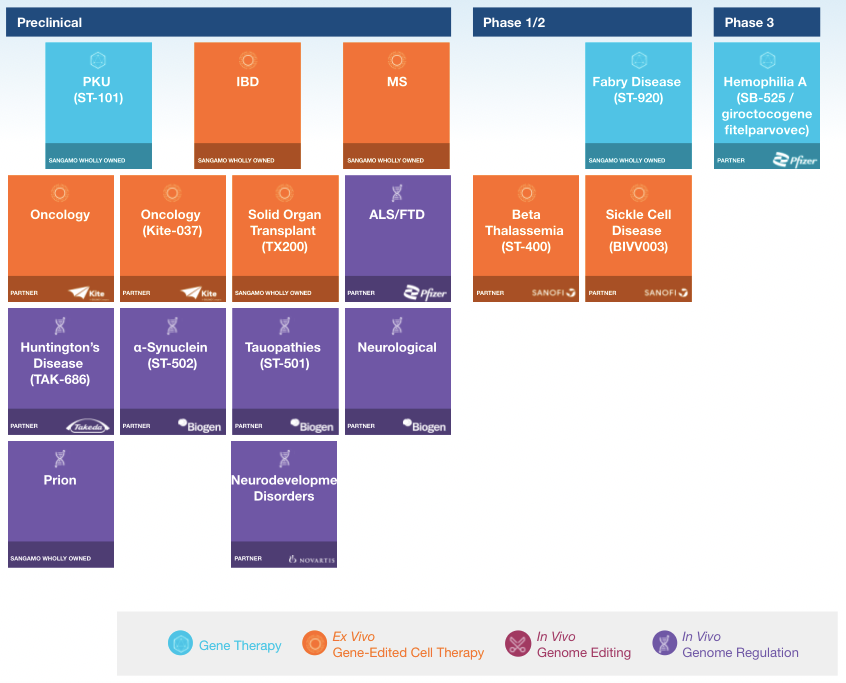 ▲圖片來源:Sangamo官方網站
▲圖片來源:Sangamo官方網站
ASC Therapeutics是一家快速發展的生物技術公司,通過其專有的基因編輯平臺TARGATTTM和其他基因編輯技術開發治療型產品,為尚珹投資在醫療領域的投資項目之一。
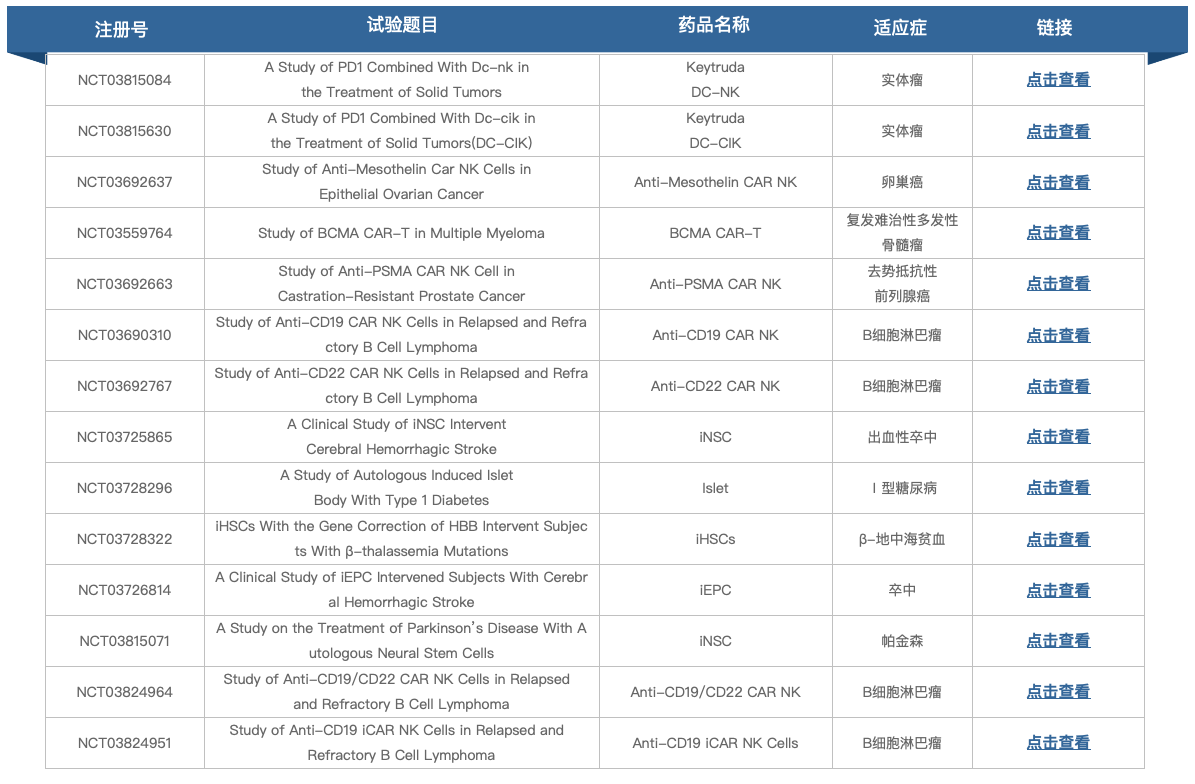
目前研發管線包括幾個臨床前階段的項目,重點關注血液病的研究。根據clinicaltrials.gov顯示,2021年4月,ASC Therapeutics公司將開展ASC-618治療中重度血友病A的安全性及初步療效評價臨床研究。另外,管線上還有治療A型血友病的基因療法ASC-518、治療B型血友病的基因療法ASC-519及治療β 地中海貧血的基因療法ASC-520處于早期研究階段。
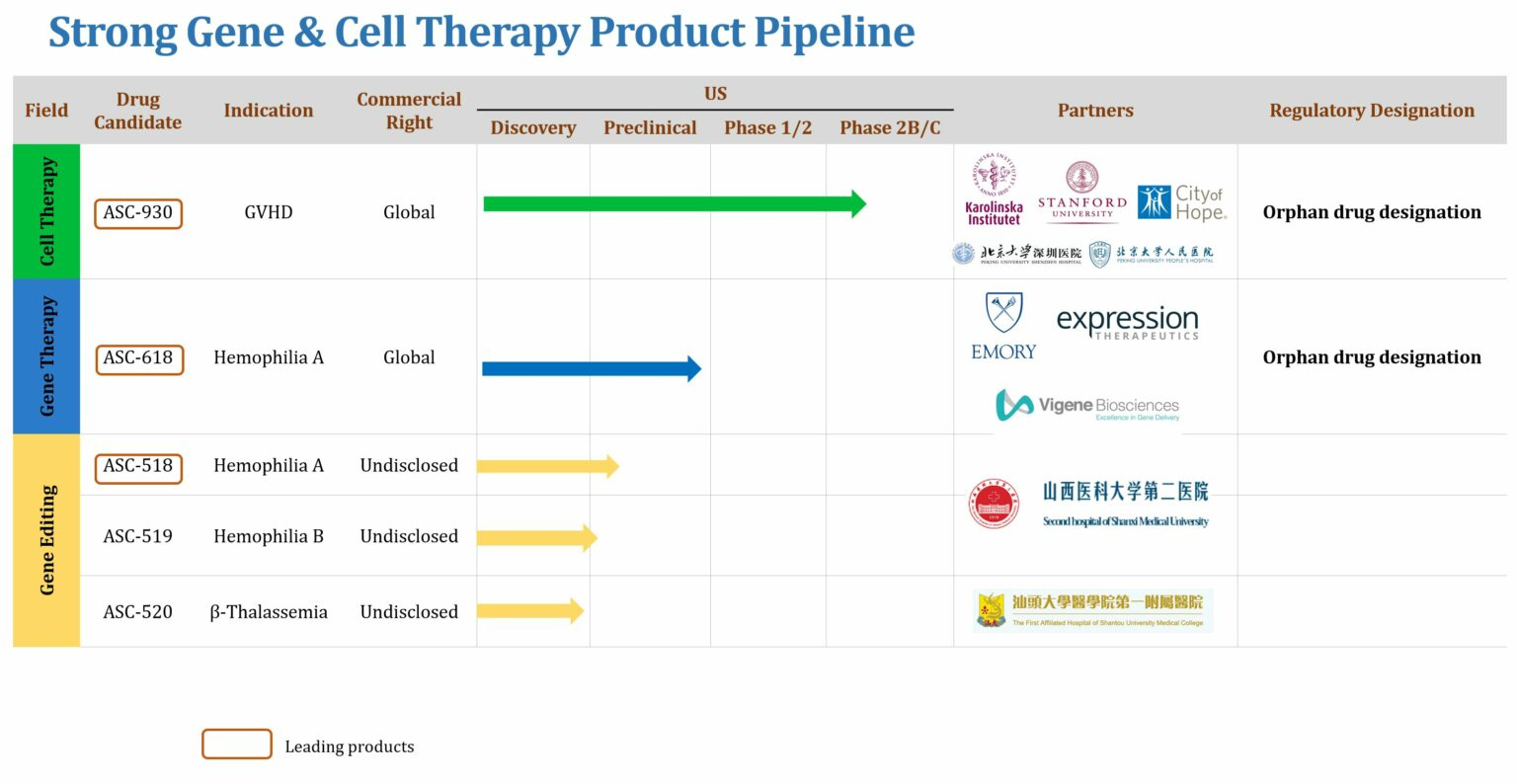 ▲圖片來源:ASC Therapeutics官方網站
▲圖片來源:ASC Therapeutics官方網站
Freeline創立于2015年,主要專注于利用基因療法的潛力為患有慢性全身性疾病的病人提供治愈性治療方法。Freeline開發了一種改進的AAV病毒衣殼,這種強大的衣殼在B型血友病患者的臨床試驗中得到驗證。
2018年,Freeline完成1.16億美元(約合人民幣7.54億元)的B輪融資,以推動其主打產品用于治療B型血友病和法布里病的臨床開發,以及其他產品管線的進展。同時新融資也將幫助Freeline進一步提高其基于AAV(腺相關病毒)衣殼的生產和進一步優化能力。
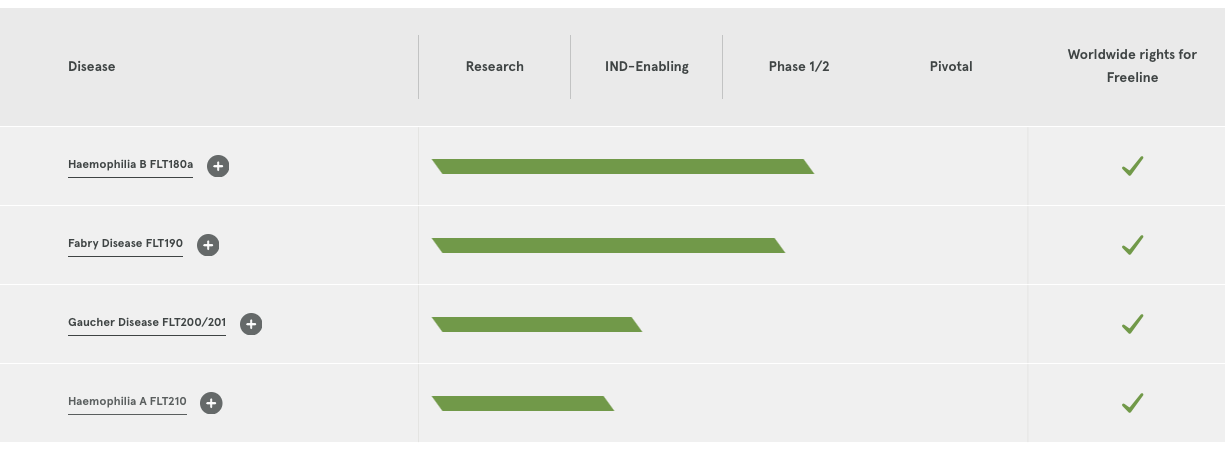 ▲圖片來源:Freeline官方網站
▲圖片來源:Freeline官方網站
Ultragenyx成立于2010年,總部位于加利福尼亞,是一家專注罕見病新藥的研發和商業化的生物醫藥公司。
Ultragenyx與拜耳合作開發的用于治療A型血友病的基因療法BAY2599023 (DTX201)使用的是Regenxbio專有的NAV AAVhu37載體。DTX201最初是由Dimension研發,Ultragenyx于2017年11月完成對Dimension Therapeutics的收購,獲得該產品。根據clinicaltrials.gov顯示,拜耳于2018年11月啟動BAY2599023(DTX201)關于成人嚴重血友病A的臨床試驗研究,這也是Bayer產品管線中唯一一款處于臨床階段的治療血友病的基因療法。
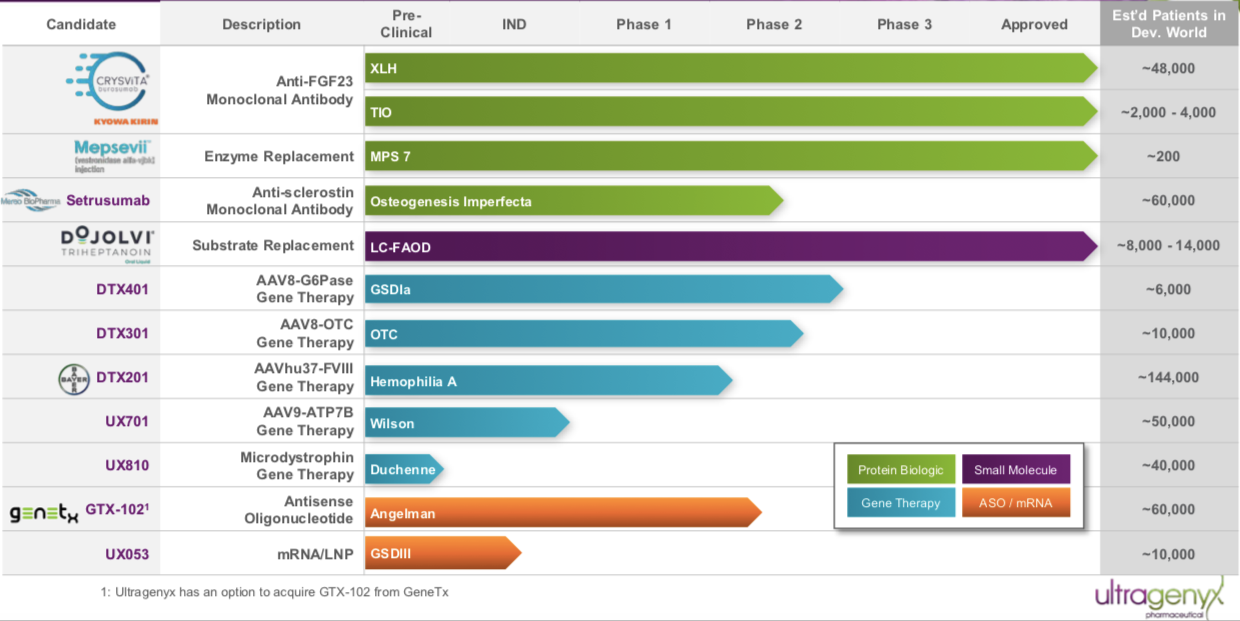 ▲圖片來源:Ultragenyx官方網站
▲圖片來源:Ultragenyx官方網站
另外值得一提的是基因治療領域的新秀Regenxbio,Regenxbio致力于AAV(Adeno-associated virus,重組腺相關病毒)基因療法的開發和商業化。Regenxbio擁有的NAV技術平臺是一種專有的AAV基因遞送平臺,包括100多種新型AAV載體,比如AAV7、AAV8、AAV9和AAVrh10。
目前,Regenxbio已將NAV技術許可給10余家公司,并據此開發了超20個候選產品,主要用于治療神經退行性疾病、血液疾病、視網膜疾病等適應癥,合作方包括Novartis、Prevail、Pfizer、Takeda等企業。其中有2款治療A型血友病的基因候選產品,目前分別由Takeda和Ultragenyx/Bayer進行后續開發。
 ▲圖片來源:Regenxbio官方網站
▲圖片來源:Regenxbio官方網站
Generation Bio創立于2016年,總部位于美國,是一家創新型基因藥物公司,利用特有的非病毒基因治療平臺創建了一類新型的基因治療產品。其創新點在遞送系統,核心技術被稱為non-viral closed-ended DNA(ceDNA),通過脂質納米顆粒進入人體,這項技術能避開基于病毒的基因治療中典型的免疫反應。Generation Bio自2018年來,先后完成三輪融資,并于2020年5月進行了IPO,同年6月于納斯達克上市。
Generation Bio的產品線包括針對肝臟和視網膜的罕見病和流行疾病的八個項目,其中苯丙酮尿癥(PKU)和A型血友病進展最快,處于臨床前研究階段。
 ▲圖片來源:Generation Bio官方網站
▲圖片來源:Generation Bio官方網站
深圳市免疫基因治療研究院是經深圳市人民政府批準設立的具有獨立法人資格的二類事業單位。研究院主要研究方向是針對癌癥的CAR-T免疫細胞治療及針對基因相關疾病的治療。
深圳市免疫基因治療研究院采用雙重干細胞基因療法治療多項遺傳疾病,對七種基因疾病進行深入研究,包括異染性腦白質營養不良、腎上腺腦白質營養不良、地中海貧血、血友病、視網膜眼睛疾病、X連鎖嚴重聯合免疫缺陷和范可尼貧血。
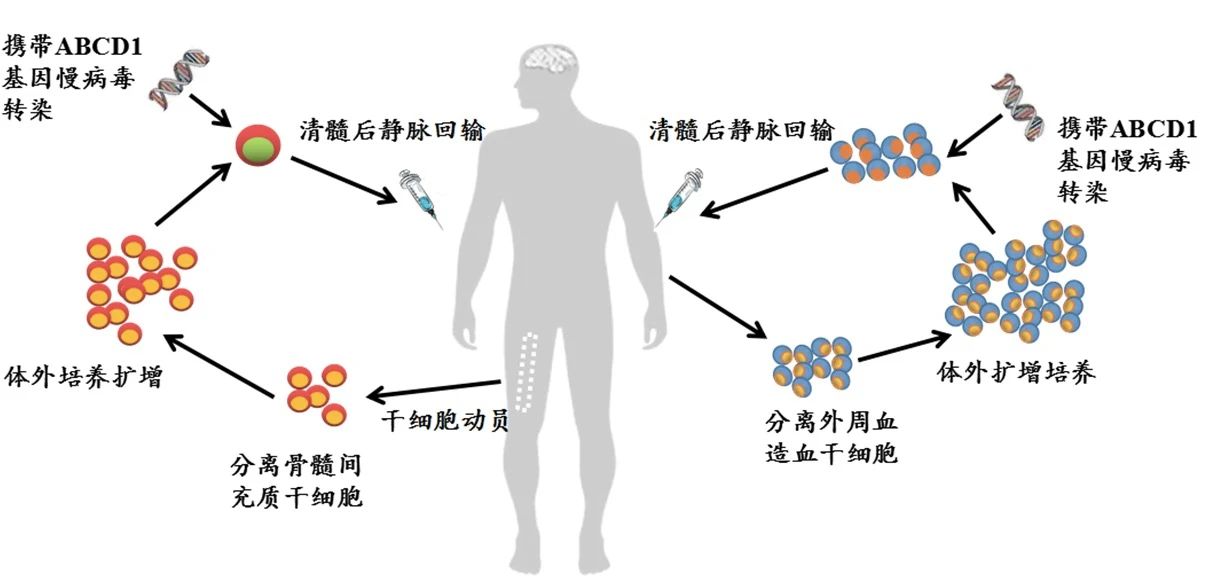 ▲圖1 深圳市免疫基因治療研究院擬采用的雙重干細胞基因治療示意圖
▲圖1 深圳市免疫基因治療研究院擬采用的雙重干細胞基因治療示意圖
雖然,我國在1991年就開展了首個針對血友病的基因治療臨床試驗,但是直到近幾年才有血友病基因療法進一步開展臨床階段。中國醫學科學院血液學研究所&血液病醫院與華東理工大學共同申請的靜脈輸注基于AAV的基因療法BBM-H901用于治療血友病B臨床試驗(NCT04135300)于2019年10月發起,這也是國內首個AAV基因治療臨床試驗。
深圳市免疫基因治療研究院的YUVA-GT-F801、YUVA-GT-F901分別用于治療A型血友病與B型血友病,目前也處于1期臨床試驗階段。
此外,深圳市免疫基因治療研究院還有關于地中海貧血、范可尼貧血的基因治療試驗也正開展臨床。
五加和基因成立于2005年,技術團隊從事病毒載體系統研究20余年,公司致力于為pre-IND和IND階段基因藥物提供符合GMP標準的病毒載體制品研發生產服務。
公司董事長兼總經理董小巖博士在2000年建立本元正陽基因技術股份有限公司基因治療新藥研發平臺。2003年,其自主研發使用AAV載體的血友病B基因藥物研發項目AAV2-hFIX獲批,系中國首個被批準的血友病B基因治療藥物臨床方案。2005年創建北京五加和,帶領團隊研發用于治療B型血友病、A型血友病、SMA、DMD、ALS、遺傳性高脂血癥、青光眼等26種疾病的基因藥物。
至善唯新成立于2018年,是一家專注rAAV基因藥物研發與顛覆式生產的國內基因治療領軍企業。公司擁有基因療法領域的專業團隊,創始人董飚從事rAAV病毒載體研究超過十年,在基因療法藥物設計與規模化生產方面均取得了突破性進展,治療領域涵蓋血液疾病、罕見病等多個疾病領域。
至善唯新擁有全球領先的新型rAAV生產系統,針對A型血友病和B型血友病都有了相應的rAAV基因藥物臨床管線布局,已經完成臨床前的動物模型驗證。其中,針對B型血友病的臨床管線是公司眼下重點推進的項目,利用有自主專利的規模化載體生產技術和高效IX因子,開發治療B型血友病的rAAV藥物,該項目將于2021年提交臨床批件注冊申報。除布局血友病方向的管線外,至善唯新利用自身在于rAAV基因治療領域儲備的技術優勢,在抗衰老和神經退行性疾病方向也有相應的管線布局,包括針對帕金森癥、老年癡呆癥的rAAV基因藥物研究等。
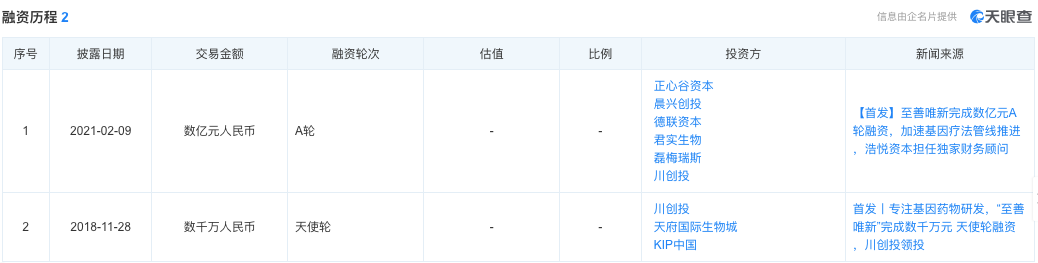 ▲圖片來源:天眼查官方網站
▲圖片來源:天眼查官方網站
至善唯新成立不足半年,便獲得由川創投領投的數千萬人民幣天使輪融資;2021年2月,又完成了數億元人民幣的A輪融資,用來加速基因療法管線的推進,其中,君實生物持有至善唯新約6.6%的股權。
信念醫藥成立于2018年,致力于基因治療藥物的產業化研發和臨床應用,包括腺相關病毒基因治療載體的前端篩選、生產工藝優化、GMP生產、臨床質控標準和臨床試驗等。信念醫藥計劃從生物科技公司逐步轉型為生物醫藥公司,目前已完成數千萬的天使輪與數億元的 A 輪融資。
信念的產品布局主要專注在開發以AAV為載體的基因療法,產品線包括血友病 A、血友病 B、帕金森癥、老年黃斑變性、粘多糖貯積癥、肌萎縮側索硬化癥、遺傳性血管水腫、嗜血細胞綜合征、法布里疾病等適應癥,其中研發最快的兩個產品就是血友病B和血友病A。
華東理工大學與血液所申報的血友病基因治療產品BBM-H901正是出自信念醫藥的子公司上海信致醫藥科技有限公司臨床藥物生產場地,位于華東理工大學國家大學科技園梅隴基地內。
此外,國際上還有很多公司正在積極布局血友病基因治療產品,如諾和諾德與藍鳥生物于2019年10月達成合作協議,雙方合作重點利用藍鳥生物的megaTAL技術開發A型血友病的基因療法;再生元與Intellia Therapeutics擴大雙方自2016年的合作,交易額達1億美元,雙方合作重點是開發治療A型血友病和B型血友病的潛在CRISPR / Cas9編輯基因治療候選藥物;賽諾菲與合作已久的慢病毒載體開發商Oxford BioMedica(OXB)利用其開發和生產用于治療血友病的慢病毒載體,首次開發基于慢病毒的體內給藥血友病基因療法等。
基因療法用于β地中海貧血
地中海貧血(Thalassemia,地貧)即珠蛋白生成障礙性貧血,是一組常染色體遺傳的溶血性貧血疾病,其致病機制是珠蛋白基因缺陷使血紅蛋白中的珠蛋白肽鏈有一種或幾種合成減少或不能合成,導致血紅蛋白的組成成分改變,進而引發紅細胞壽命縮短,表現為慢性溶血性貧血。根據珠蛋白鏈缺乏種類不同,地中海貧血分為α型、β型、δβ型、δ型和ebgδ型,其中臨床上以β和α型地貧最為常見,α-地貧又分靜止型、輕型、中間性和重型;β-地貧又分輕型、中間型和重型。
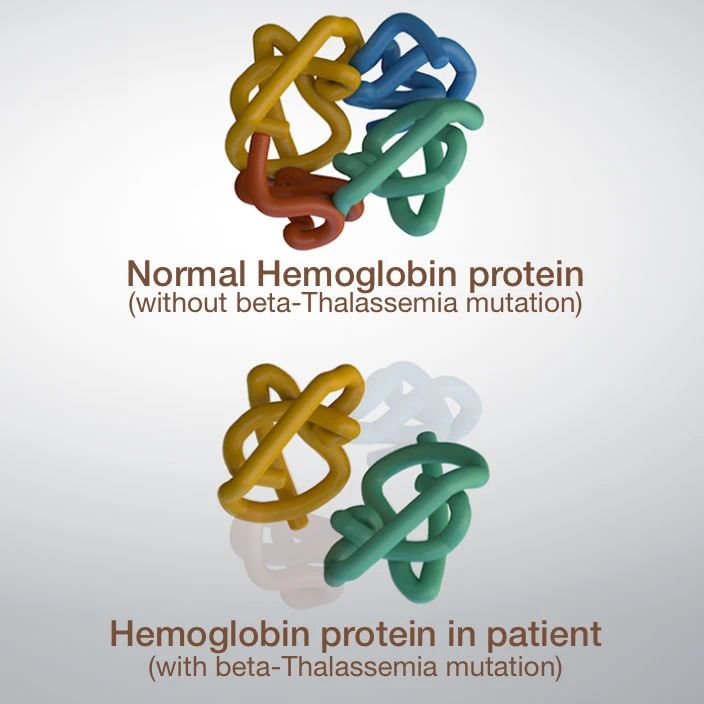 ▲圖2 β-地貧致病機制示意圖
▲圖2 β-地貧致病機制示意圖
目前,針對β-地貧的療法有輸血替代治療、脾臟切除和造血干細胞移植治療等。其中定期輸血是臨床上比較常規的治療方案,患者需要終身治療,治療費用昂貴且易產生輸血副反應,還須同時接受去鐵治療,但去鐵治療也同樣會伴隨嚴重不良反應,常用鐵螯合劑包括得斯芬、奧貝安可、恩瑞格等;對于經正常輸血治療及去鐵治療后鐵負荷仍增加的患者考慮脾臟切除,但此治療方案會增加嚴重敗血癥發生的風險,且對重癥β-地貧患者效果仍差強人意;造血干細胞移植治療是目前能夠根治的唯一方案,可通過骨髓移植、外周血干細胞移植、臍血移植等方案將健康人的造血干細胞移植至病人體內,但配型十分困難,且供體來源有限,即使配型成功仍需長期服用免疫抑制藥物,治療費用也十分昂貴。
在β 地中海貧血(TDT)治療領域,也有一些新藥獲批,BMS的Reblozyl就是第一個獲FDA批準治療β 地中海貧血相關貧血的藥物,同時也是十多年來第一個獲FDA批準用于需要輸注紅細胞(RBC)且接受一種紅細胞生成刺激劑治療失敗的骨髓增生異常綜合癥(MDS)患者的新治療方案。特別值得注意的是,在需要立即糾正貧血的患者中,Reblozyl不適用于作為紅細胞輸注的替代品。此前,華爾街投行Jefferies分析師預測,Reblozyl獲FDA批準后的年銷售峰值將達到20億美元。
基因療法為β地中海貧血提供了新的治療思路,將造血干細胞從病人自身的外周血中收集后,通過病毒載體導入正常的珠蛋白基因以使細胞功能恢復正常,再將改造后的造血干細胞回輸給病人。這種治療方案的優勢在于,供體來源不需要通過捐贈、異體移植,解決了干細胞來源不足以及配型困難等問題,一次治療就可能滿足永久性的“治愈”,有望取代目前并不完美的治療方案。
2019年5月,全球首個治療輸血依賴型β地中海貧血的基因療法Zynteglo獲得歐洲藥品管理局(EMA)有條件批準,也有多家企業正在進行β 地中海貧血基因療法的臨床及臨床前的實驗研究。
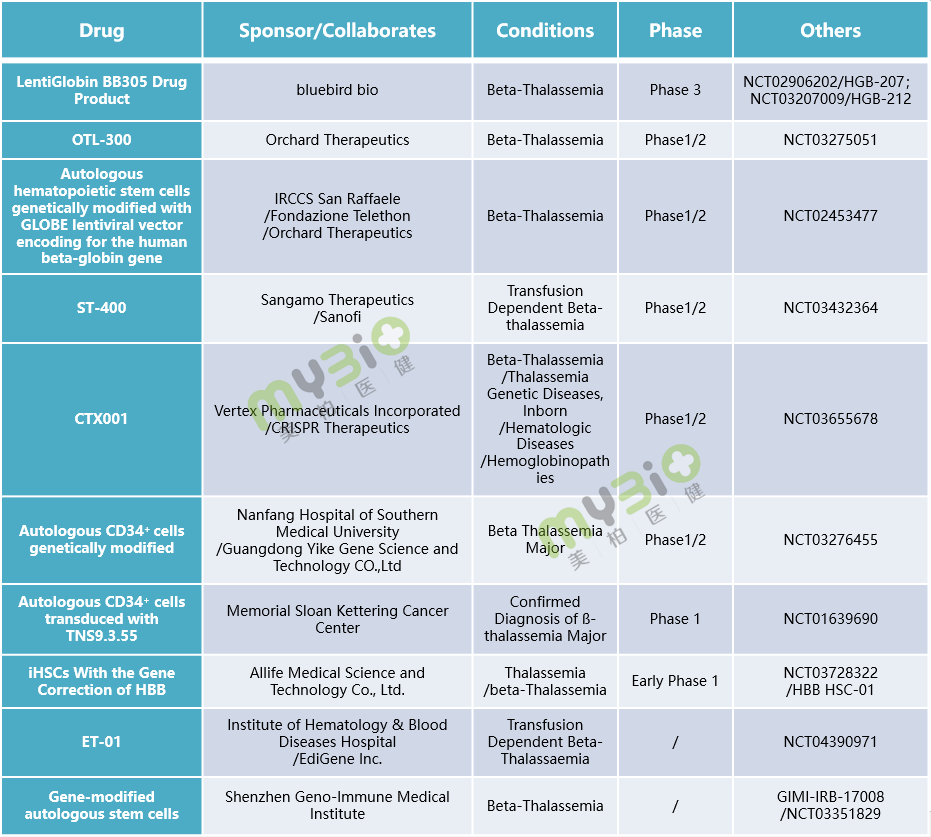 ▲表2 處于臨床階段的部分β 地中海貧血基因治療候選療法
▲表2 處于臨床階段的部分β 地中海貧血基因治療候選療法這種一次性的基因治療方法,可直接解決β地中海貧血的內在基因病因,有潛力使患者擺脫輸血依賴(輸血非依賴),一旦成功,患者將終身受益。
研發基因療法用于治療β地中海貧血的代表公司:
藍鳥生物公司(bluebird bio)創立于1992年,總部位于美國,原名Genetix Pharmaceuticals, Inc.,于2010年9月改為bluebird bio,是一家致力于為治療嚴重的遺傳疾病和罕見疾病開發革命性基因療法的臨床階段生物技術公司。
藍鳥生物的基因產品LentiGlobin治療β 地中海貧血已獲EMA批準,這是針對β-地中海貧血的首款基因療法,LentiGlobin的另一適應癥SCD正處于臨床研究階段。
 ▲圖片來源:bluebird bio官方網站
▲圖片來源:bluebird bio官方網站
Orchard成立于2015年,位于英國,是一家致力于為患有嚴重和危及生命的孤兒疾病的患者提供變革性基因治療的公司,將利用離體自體造血干細胞基因治療的潛力來恢復正常的基因功能。
OTL-300是一種實驗性自體體外慢病毒基因療法,2018年4月,Orchard從葛蘭素史克收購該基因療法,EMA已授予OTL-300治療TDT的優先藥物資格。繼收購GSK基因療法后,Orchard獲1.5億美元C輪融資,隨后IPO上市。
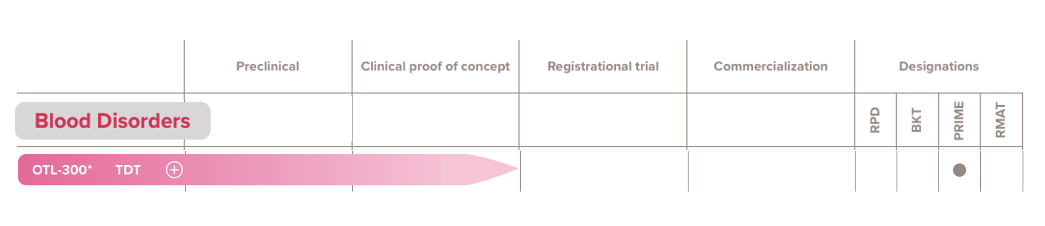 ▲圖片來源:Orchard官方網站
▲圖片來源:Orchard官方網站
CRISPR Therapeutics于2013年10月成立于瑞士,研究中心在馬薩諸塞州劍橋,由獲得2020年諾貝爾化學獎的Emmanuelle Charpentier及其同事創立,致力于利用其專利 CRISPR/Cas9 基因編輯平臺開發革命性藥物。Vertex成立于1989年,是一家致力于開發治療嚴重疾病藥物的生物技術公司,囊性纖維化治療領域的全球領導者,目前已上市多款囊性纖維化療法。CRISPR Therapeutics與Vertex也建立了戰略合作伙伴關系,開發基于CRISPR技術的基因治療方案。
2015年,CRISPR與Vertex達成合作,雙方協議利用CRISPR/Cas9 基因編輯技術去發現和開發針對人類疾病內在基因原因的潛在新療法,CTX001就是利用這項合作的首個成果。2018年,CTX001獲得了美國和歐洲監管機構的新藥研究申請批件,這也是全球首個由制藥公司發起的體外CRISPR療法的新藥臨床試驗。目前,CTX001處于I/II期臨床試驗階段,獲得了FDA 授予的再生醫學高級療法(RMAT)、快速審評通道、孤兒藥和罕見兒科疾病藥物稱號,還獲得EMA授予的針對鐮狀細胞病和 β 地中海貧血的孤兒藥稱號以及針對鐮狀細胞病的優先審評藥物資格。
 ▲圖片來源:CRISPR官方網站
▲圖片來源:CRISPR官方網站
由CRISPR領域的領軍人物張鋒和Jennifer Doudna共同創建的Editas成立于2013年,是最早上市的CRISPR-Cas9技術公司。
公司的研發管線中治療伯氏先天性黑蒙癥的EDIT-101療法進展最快,已經進入臨床階段,其次是EDIT-301療法,用于鐮狀細胞病與β 地中海貧血。
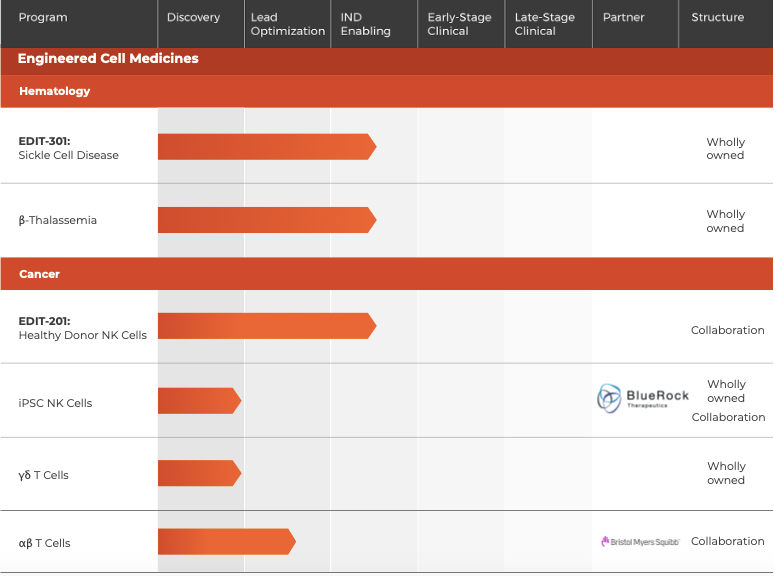 ▲圖片來源:Editas官方網站
▲圖片來源:Editas官方網站
上文提到,Sangamo與Pfizer合作開發A型血友病基因療法SB-525,Sangamo還與Sanofi合作將ZFN基因編輯技術應用于輸血依賴性β-地中海貧血的治療,其相關產品ST-400處于1/2期臨床試驗階段。
近年來,Sanofi不斷布局基因療法領域。自2018年1月完成收購專注于血友病的Bioverativ公司后,Sanofi也公布了許多基因療法相關的積極消息,除與Sangamo合作開發ST-400外,雙方還共同研究治療鐮狀細胞病的基因療法BIVV003;2019年,Sanofi首個基于AAV的基因療法進入臨床,用于治療由常染色體隱性鳥苷酸環化酶2D(GUCY2D)突變引起的Leber先天性黑朦(LCA)的罕見眼科疾病;2021年2月,Sanofi與Sirion也達成合作,雙方共同開發基于病毒載體的基因傳遞技術。
博雅輯因成立于2015年,是一家致力于通過國際前沿的基因組編輯技術,為多種遺傳疾病和癌癥加速藥物研究以及開發創新療法的生物醫藥企業。博雅輯因有造血干細胞平臺、通用型CAR-T平臺、體內療法-RNA堿基編輯平臺、高通量基因組編輯篩選-新藥研發平臺四大平臺。其中,造血干細胞平臺通過基因編輯自體造血干細胞,針對β地中海貧血病和其他貧血病的創新療法。
博雅輯因利用四大技術平臺已經開發了十余條產品管線,其中進展最快的是一種體外基因療法,針對輸血依賴型β地中海貧血的ET-01和針對癌癥的異體CAR-T ET-02。ET-01基于CRISPR的基因編輯療法,通過提高患者胎兒血紅蛋白水平彌補正常β血紅蛋白的不足。臨床前研究證明了該方法的可行性。2020年10月,中國國家藥品監督管理局受理了我國首個CRISPR基因編輯療法臨床試驗申請。
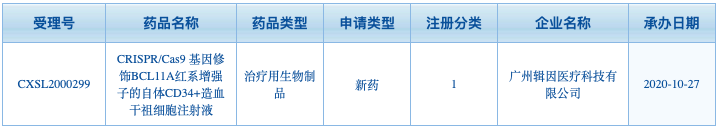 ▲圖片來自:國家藥品監督管理局藥品審評中心官網
▲圖片來自:國家藥品監督管理局藥品審評中心官網
博雅輯因的ET-01項目也受到國際上的認可,2019年,在第61屆美國血液學年會(ASH)上,博雅輯因發布了其β地中海貧血基因編輯治療項目的規模化生產及臨床前安全性和有效性試驗數據。
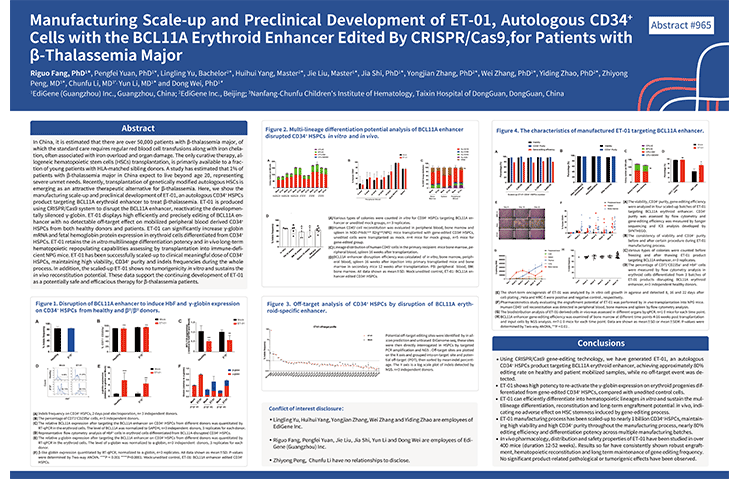 ▲圖片來自:博雅輯因官方網站
▲圖片來自:博雅輯因官方網站
呈諾醫學(Allife Medical Science and Technology Co., Ltd.)創立于2017年,由中英兩國科學家創辦。公司立足于自主研發的iPSC誘導多能干細胞技術平臺,致力于開發國際前沿的創新型功能細胞治療藥物。
呈諾醫學擁有成熟的誘導多能干細胞(iPSC)制備技術,以此為基礎研發了針對罕見病、帕金森、糖尿病和心血管疾病的治療產品,現階段將側重于法布雷(Fabry)和漸凍癥(ALS),這兩種罕見病在中國有十幾萬患者需要治療。另外,呈諾醫學的腫瘤免疫細胞產品以自然殺傷細胞(NK)為基礎,從技術角度看,CAR-NK療法安全性更好,且易獲得,易操控,免疫原性較低;從臨床結果看, CAR-NK對癌細胞的殺傷效果同CAR-T療法也不相上下。
 ▲圖片來源:呈諾醫學官方網站
▲圖片來源:呈諾醫學官方網站
跟據clinicaltrials.gov顯示,呈諾醫學CRISPR-Cas9處理的誘導造血干細胞治療β地中海貧血試驗處于早期1期臨床試驗階段,未有其他進展,官方網站也未查詢到相關管線信息。
 ▲圖片來源:https://www.clinicaltrials.gov
▲圖片來源:https://www.clinicaltrials.gov
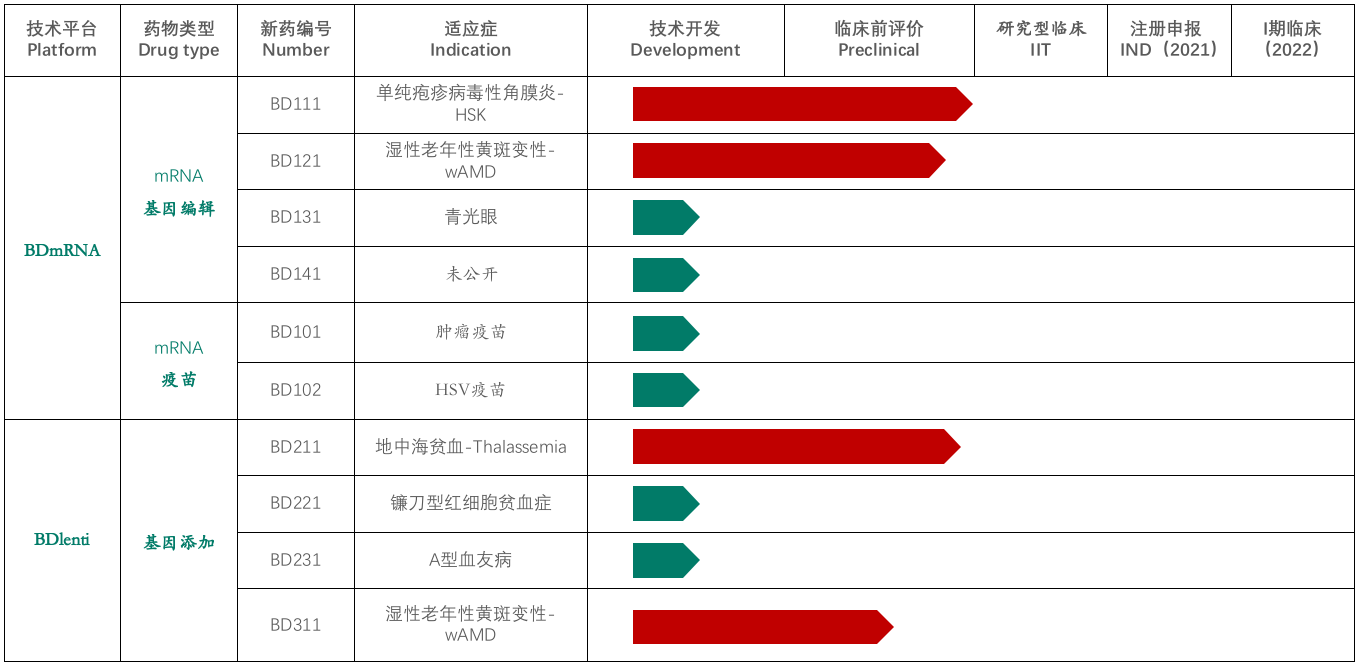
本導基因成立于2018年,是一家基因治療創新藥物開發的企業,擁有mRNA遞送與基因編輯平臺、第四代慢病毒載體平臺、溶瘤病毒平臺,主要用于治療糖尿病黃斑變性、濕性老年黃斑變性(wAMD)、造血系統遺傳疾病等疾病。
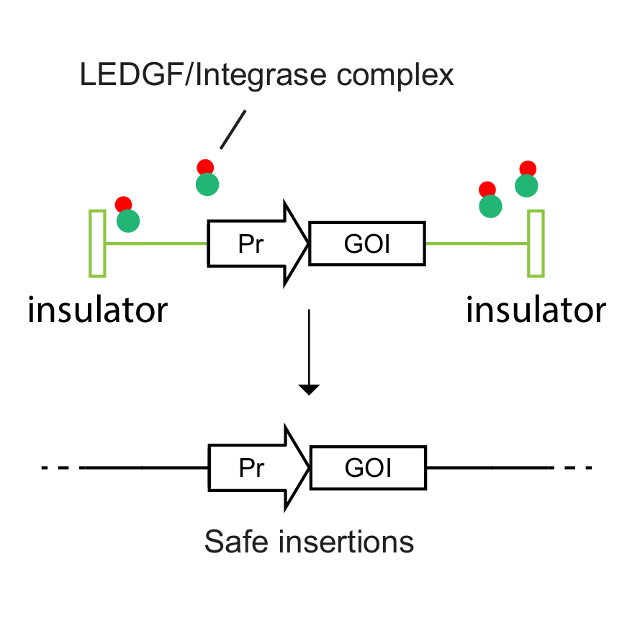
本導基因的基因添加——BDlenti平臺使用先進的慢病毒載體遞送技術,有效地提高了病毒產量以及造血干細胞的感染效率。BDlenti遞送技術加入了獨特的優化策略,可以降低基因整合突變的風險。同時,讓治療性基因在患者體內長期表達,而不會因為基因沉默而失掉療效。
 ▲圖片來源:本導基因官方網站
▲圖片來源:本導基因官方網站
基于BDlenti遞送技術,本導基因開發了治療地中海貧血癥的基因療法BD211,目前也是公司開發的產品管線中進展較快的基因療法之一,適應癥還包括鐮刀形紅細胞貧血癥,但目前僅處于技術開發階段。此外,本導基因還在2020年6月完成了千萬級人民幣的pre-A輪融資,用于推進基于mRNA遞送的基因治療產品的臨床應用。
 ▲圖片來源:本導基因官方網站
▲圖片來源:本導基因官方網站
上海邦耀生物科技有限公司成立于2013年,依托在基因編輯、免疫學領域的強大技術實力和科研團隊,致力于基因編輯與細胞治療的研發與轉化,以及基因突變引起的遺傳疾病的基因治療。
邦耀生物已搭建基因編輯、細胞治療與基因治療三大具有自主知識產權的技術平臺,其中基因編輯治療β 地中海貧血癥、PD1定點整合的非病毒CART、以及UCART等項目已經取得優異臨床效果。
 ▲圖片來源:邦耀生物官方網站
▲圖片來源:邦耀生物官方網站
2019年3月,Nature Medicine在線發表了邦耀生物關于基因編輯療法用于地貧治療的研究成果。結果表明,通過CRISPR/Cas9技術重新開啟胎兒期的γ珠蛋白的表達,從而代替有缺陷的β珠蛋白,達到緩解地貧癥狀的目的,具有很大的臨床轉化潛力。
瑞風生物成立于2019年,是一家以基因編輯為核心技術的藥物創新企業,目前處于臨床前階段。
基于革新性的基因編輯技術,瑞風生物目前在遺傳病、復雜疾病和腫瘤領域等皆有管線布局,其中進展最快的β-地中海貧血基因編輯療法。
 ▲圖片來源:瑞風生物官方網站
▲圖片來源:瑞風生物官方網站
除制藥企業之間的合作,還有醫院與企業合作共同開發β地中海貧血基因療法,如廣州南方醫院與廣東銥科基因科技有限公司共同申報一項基因治療重癥β地中海貧血的研究(NCT03276455),銥科基因是賽爾生物的控股子公司,首席研究員李春富博士有“中國地貧之父”之稱,目前該研究處于1/2期臨床研究階段;意大利IRCCS San Raffaele醫院使用GLOBE慢病毒載體轉導自體HSC的策略,與Orchard等共同申報的β 地中海貧血基因治療臨床試驗正處于I/II期臨床試驗階段(NCT02453477),這也是第一個同時應用于成人和兒科患者的β 地中海貧血基因治療臨床試驗。
鐮狀細胞病(Sickle Cell Disease,SCD)是一組由β-珠蛋白基因突變引起的遺傳性紅細胞疾病。正常情況下,健康的紅細胞呈圓盤狀,易于在血管中移動,將氧氣輸送至身體的各個部位,但基因突變所導致的鐮狀紅細胞阻礙血液流動,從而引發貧血等其他嚴重問題,特別是血管阻塞性危象(vaso-occlusive crises,VOC)。VOC也被稱為鐮狀細胞疼痛危象(sickle cell pain crisis,SCPC),是由多細胞粘附或阻斷血流的細胞簇所觸發,可導致嚴重的急性和慢性危及生命的并發癥和死亡。它是SCD患者急診室就診和住院的最常見原因,在SCD患者中,當多個血細胞粘在一起并黏附在血管上時,VOC就會發生,導致阻塞,但是目前能夠預防VOC的方案也非常有限。
目前,針對SCD的治療方法包括藥物治療、輸血和干細胞移植。
最早被批準用于治療鐮狀細胞疾病的藥物是Hydroxyurea(羥基脲),但該藥物只能用來緩解癥狀,并不能治愈;2017年,Emmaus Medical公司研發的Endari(L-谷氨酰胺口服粉劑)被FDA批準用于治療5歲及以上的SCD患者,有助于限制血管阻塞性危象的持續時間、嚴重程度和發生頻率;2019年,有兩款治療SCD的藥物獲得FDA的上市批準,分別是諾華研發的Adakveo(Crizanlizumab)與Global Blood Therapeutics(GBT)研發的Oxbryta(Voxelotor),Crizanlizumab是首款獲批治療VOC的靶向療法,2020年在歐洲也獲得了批準;但目前這兩款藥均未在國內獲批。干細胞移植法可以治愈SCD,但是供體來源有限,在臨床上也有諸多局限。
2017年,國際權威醫學期刊《新英格蘭醫學雜志》(NEJM)上發表了一項研究成果,通過基因治療“治愈”了一位15歲鐮狀細胞病患者。能徹底治愈SCD的基因療法被寄予厚望,目前大家也在進行積極的嘗試。
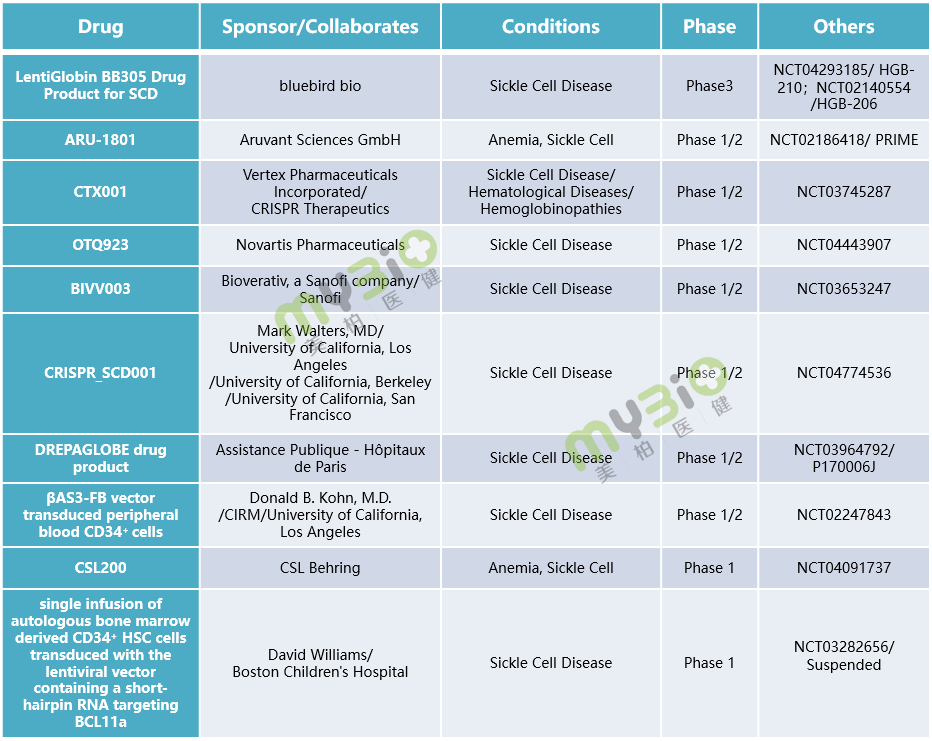 ▲表3 處于臨床階段的部分鐮狀細胞病基因治療
▲表3 處于臨床階段的部分鐮狀細胞病基因治療基因療法區別于傳統小分子、單雙抗藥物等治療方式,在治療具有遺傳性的血液疾病上具有獨特的優勢,大多數公司在開展試驗研究時可能也不止選擇一個適應癥。如同一種基因療法可能會應用于治療地中海貧血與鐮狀細胞病中,前者是應用基因療法技術改變血紅蛋白結構,后者是改變細胞形狀。
研發基因療法用于治療鐮狀細胞病的代表公司:
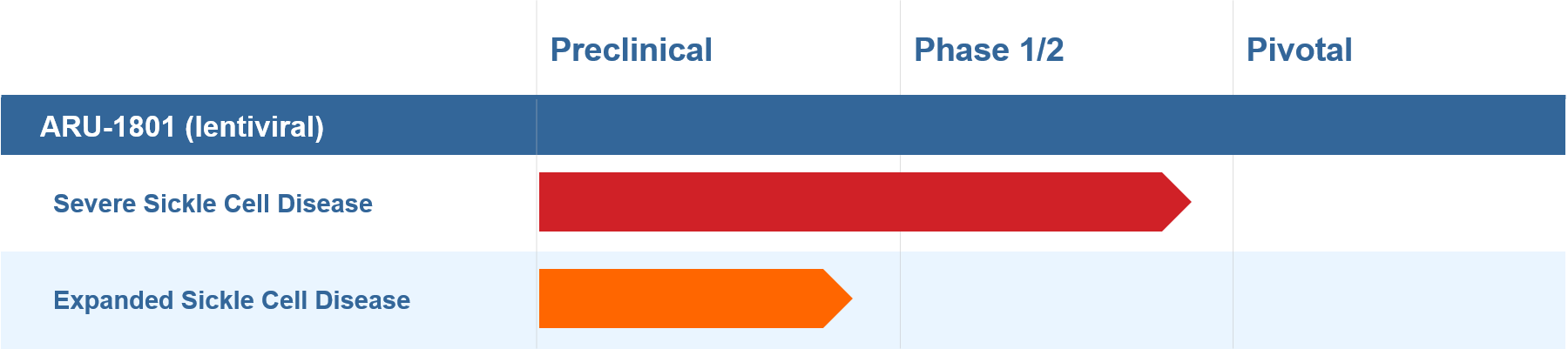
瑞士生物制藥公司Roivant Sciences的子公司Aruvant Sciences是一家臨床階段生物制藥公司,致力于開發針對罕見疾病的變革性療法并將其商業化。
Aruvant的主要候選產品ARU-1801是一種針對SCD的個體潛在治愈型慢病毒基因療法,目前正處在臨床試驗階段。作為一次性治療SCD的基因療法,ARU-1801目前已經獲得FDA治療SCD的罕見兒科疾病資格認定(RPD)和孤兒藥資格(ODD)以及EMA授予的優先藥品資格(PRIME)。
 ▲圖片來源:Aruvant 官方網站
▲圖片來源:Aruvant 官方網站
CSL Behring是澳洲最大上市醫療公司、全球血液制品巨頭CSL的子公司。上文在介紹UniQure的血友病管線時也提到,CSL Behring與UniQure就B型血友病患者的基因治療產品達成合作,早前CSL Behring也曾收購美國生物科技公司Calimmune及其專有的體外造血干細胞基因治療平臺,其造血干細胞基因療法便是用于治療鐮狀細胞疾病及b地中海貧血。
CSL Behring研發管線中,除治療SCD的基因療法CSL200外,也有血漿衍生血紅素療法CSL889,該療法也獲得了歐盟委員會和FDA的孤兒藥資格認定。此外,還有已上市的治療A型血友病的Afstylaò與治療B型血友病的Idelvionò。
 ▲圖片來源:CSL Behring官方網站
▲圖片來源:CSL Behring官方網站
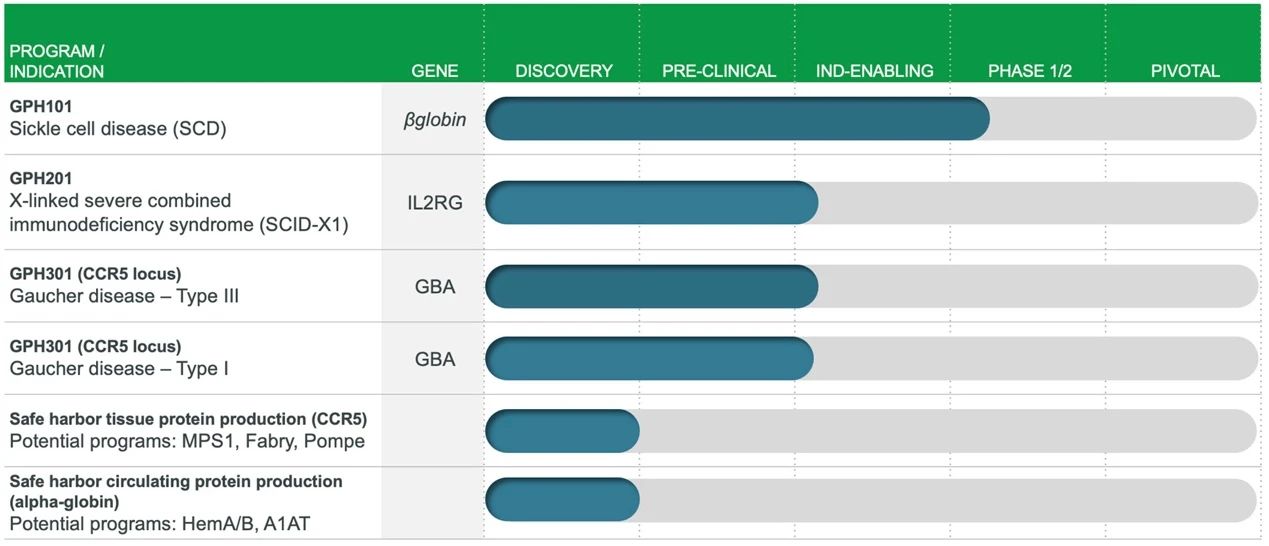
Graphite Bio創立于2019年,是一家美國基因編輯技術服務商,Graphite的技術方法基于其科學聯合創始人Matthew Porteus博士和Maria Grazia Roncarolo博士的學術成果,Matthew Porteus博士同時也是CRISPR Therapeutics的科學創始人。Graphite成立時間雖短,但已經進行了兩輪融資,在2021年的3月15日,Graphite完成了1.5億美元的B輪融資,此前完成4500萬美元的A輪融資。
Graphite Bio主要利用基因編輯與造血干細胞移植技術進行療法開發。目前,Graphite管線上已經有6款在研基因療法,適應證包括SCD、X連鎖重癥聯合免疫缺陷病和戈謝病等。2020年12月,Graphite宣布,治療SCD的候選藥物GPH101的IND申請已獲FDA批準,首個臨床I/II期試驗即將啟動,Graphite計劃2021年初開始招募CEDAR臨床試驗,也讓我們期待這項試驗結果(clinicaltrials.gov上尚未收錄)。
 ▲圖片來源:Graphite 官方網站
▲圖片來源:Graphite 官方網站
Intellia公司成立于2014年,公司創始人詹妮弗·杜德娜(Jennifer Doudna)獲得 2020 諾貝爾化學獎,是CRISPR基因編輯領域的權威人士。
OTQ923/HIX763是Intellia與Novartis合作開發的一種基于CRISPR/Cas9基因組編輯的造血干細胞(HSCs)療法,用于治療SCD。Novartis對于基因治療領域也在積極布局,2018年,Novartis以87億美金收購基因治療公司AveXis,并獲得全球首個治療SMA的基因治療產品Zolgensma;2020年,Novartis又以2.8億美元收購Vedere Bio公司,并獲得其全套的眼科疾病基因治療平臺,擴大在基因治療和細胞療法領域的優勢。目前,Novartis在基因領域有4項臨床項目、19個臨床前項目。
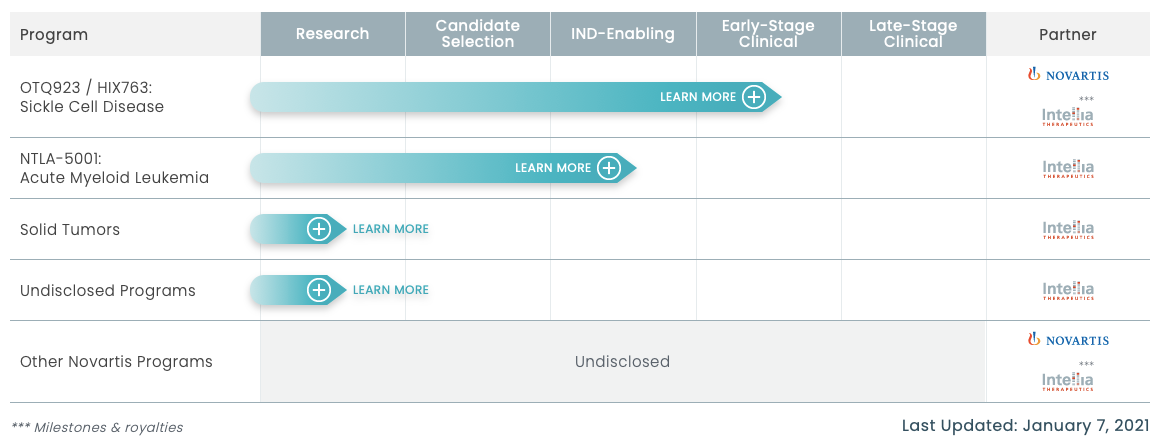 ▲圖片來源:Intellia官方網站
▲圖片來源:Intellia官方網站
Beam成立于2017年,是首家利用單堿基編輯技術開發精準基因藥物的生物技術公司,由張鋒教授、David Liu教授以及J. Keith Joung教授共同創立。2020年2月,Beam在納斯達克上市,IPO當日募集超1.8億美元;2021年2月,Beam宣布,以1.2億美元收購用于基因療法的非病毒載體遞送工具的開發商Guide Tx,加碼基因療法研究。
在Beam的產品管線上我們能看到,暫時還未有在研候選產品進入臨床試驗階段。Beam用于治療血液疾病的基因療法BEAM-101和BEAM-102是基于電穿孔技術,將基礎編輯工具插入從患者體內提取的細胞中,以治療TDT和SCD,預計會在2021年內開始第一次人體臨床試驗。
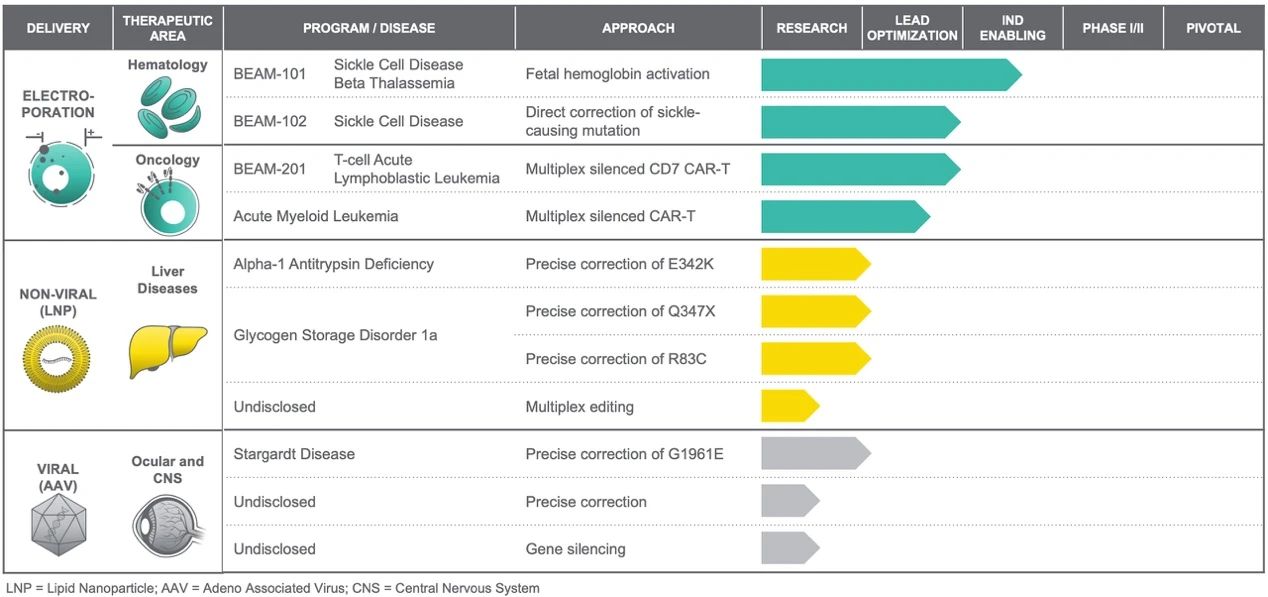 ▲圖片來源:Beam官方網站
▲圖片來源:Beam官方網站
加利福尼亞大學Mark研究了一種治療SCD的療法 CRISPR_SCD001,該療法使用CRISPR/Cas9編輯過的造血干細胞(稱之為CRISPR_SCD001藥品)進行移植(HSCT)。另外還有像上文中提到的bluebird bio、CRISPR Therapeutics、Editas Medicine、本導基因等制藥企業、科研院校及機構也在積極開發SCD的基因療法。
范可尼貧血(Fanconi anemia,FA)是一種罕見的常染色體隱性遺傳性血液系統疾病,與DNA鏈間鉸鏈修復缺陷而引起的染色體不穩定有關。除典型的血液系統癥狀之外,還可能伴隨骨骼畸形、性發育不全等,甚至可導致嚴重的并發癥如骨髓衰竭、急性髓樣白血病(AML)、骨髓增生異常綜合癥(MDS)等。2018年5月國家衛健委公布的《第一批罕見病目錄》中,范可尼貧血與地中海貧血均被收錄。
對于范可尼貧血的第一線治療是雄性激素療法和造血生長因子療法,但是只有50%-75%的患者對藥物治療有反應。雄激素療法代表藥如羥甲烯龍(oxymetholone),在治療中通常是羥甲烯龍聯合較小量潑尼松,但在治療期間要注意肝功損害等毒副作用問題;造血生長因子如G-CSF和GM-CSF能改善造血,特別是對于中性粒細胞減少的患者,能增加其中性粒細胞絕對值,代表藥如首款口服血小板生成素艾曲泊帕(Eltrombopag,Promacta,Revolade)。
造血干細胞移植法(HSCT),特別是HLA匹配同胞供者異基因造血干細胞移植法(MSDallo-HSCT)是治療范可尼貧血最有效方法,不僅能夠治愈范可尼貧血患者,也能預防并發癥白血病的發生,但仍需要面對供體來源的問題。 目前,基因治療的研究正在火熱進行中,臨床上也亟需為范可尼貧血患者開發更有效的療法。
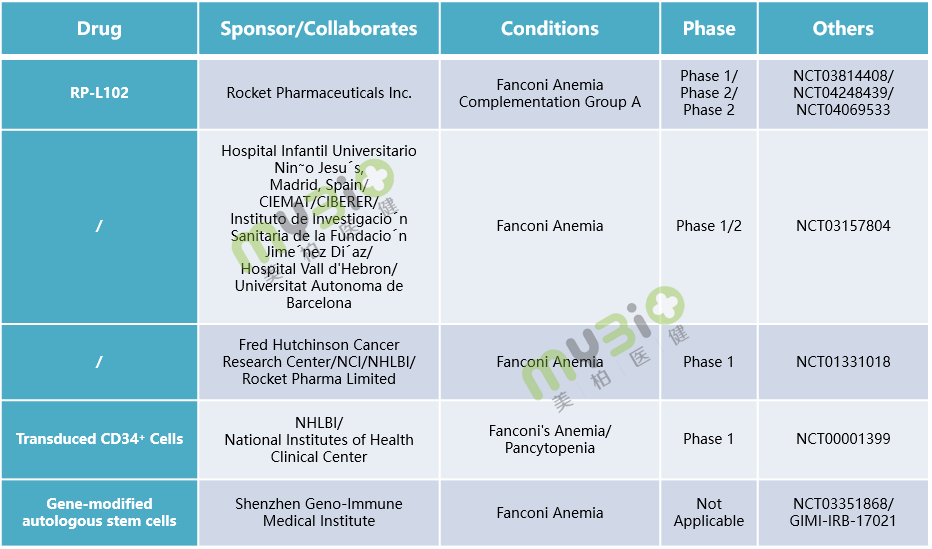 ▲表4 處于臨床階段的部分范可尼貧血基因治療候選療法
▲表4 處于臨床階段的部分范可尼貧血基因治療候選療法相對于其他的遺傳性血液疾病如血友病、地中海貧血等,基因療法用于范可尼貧血的研究相對較少,但這也并不影響我們從科學理論的角度出發,去相信基因療法會成為范可尼貧血等疾病的終結者。
研發基因療法用于治療范可尼貧血的代表公司:
Rocket是一家多平臺基因治療公司,應用成熟的慢病毒載體(LVV)和腺相關病毒載體(AAV)基因治療平臺,開發罕見的、毀滅性疾病的基因療法。
Rocket現有5項基因治療候選產品,其中4項基于LVV平臺所開發,1項基于AVV平臺。目前進展最快的是用于治療范可尼貧血的基因療法RP-L102和用于促進白細胞粘附的基因療法RP-L201。其他的基因療法包括治療Danon病的RP-A501、治療丙酮酸激酶缺乏癥(PKD)的RP-L301以及治療小兒惡性骨硬化病(IMO)的RP-L401也均處在臨床試驗研究階段。
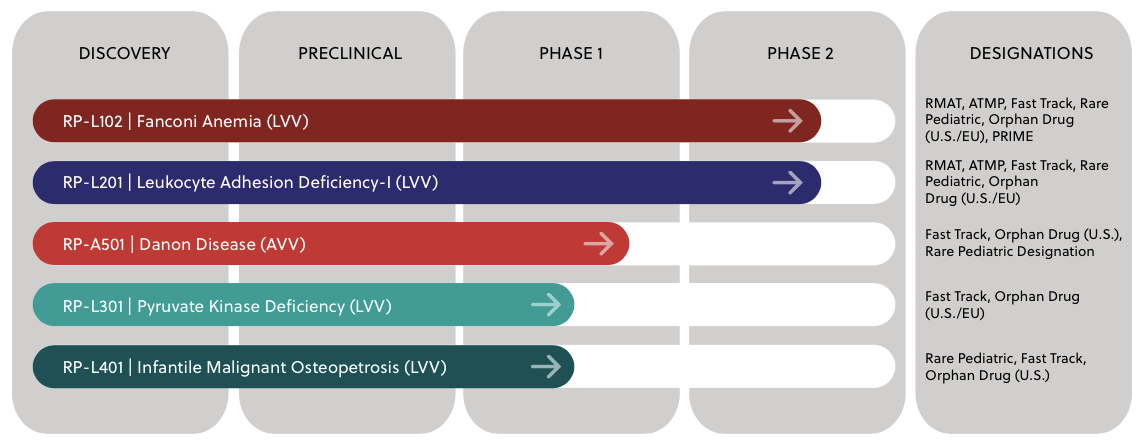 ▲圖片來源:Rocket官方網站
▲圖片來源:Rocket官方網站
StrideBio成立于2015年,是一家專注于開發基于腺相關病毒(AAV)基因療法的公司。StrideBio于2018年獲得1570萬美元的A輪融資,在2021年3月,StrideBio又完成超額認購的B輪融資8150萬美元,該資金將用于進一步優化公司產品管線。
StrideBio利用其專有的STRIVE?平臺,設計改造AAV載體,以呈現獨特的AAV衣殼,改進基因療法的組織特異性、轉導效率等。基于該技術,StrideBio與Takeda、Sarepta等公司展開合作,管線中進展最快的是治療范可尼貧血的基因療法STRX-110與治療尼曼匹克癥C型的STRX-210。
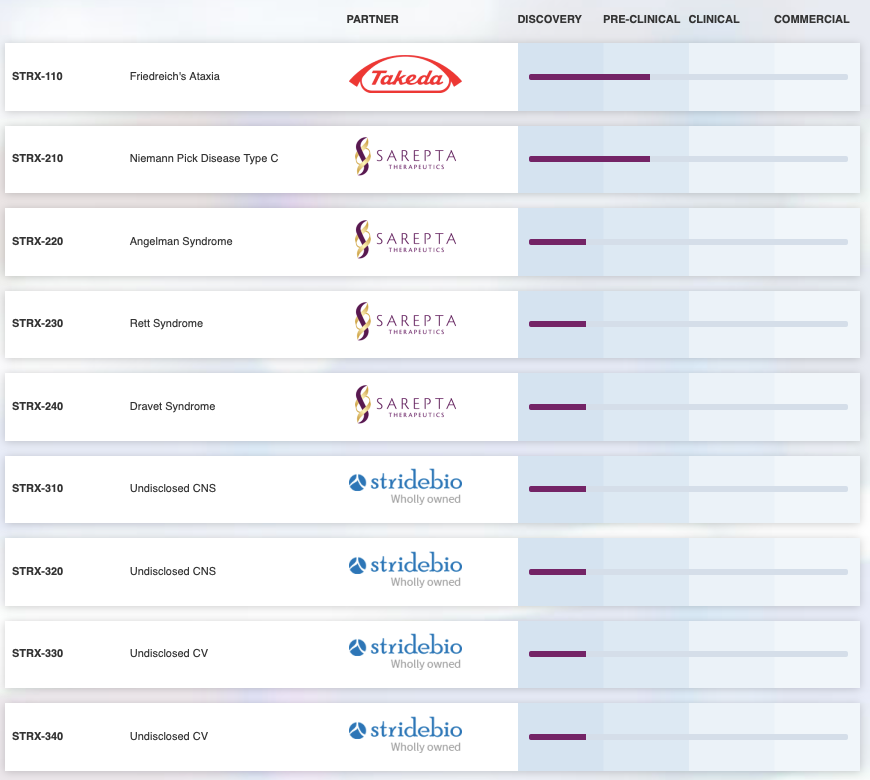 ▲圖片來源:Stridebio官方網站
▲圖片來源:Stridebio官方網站
另有消息稱,Abeona公司曾采用一種新型的基于CRISPR/Cas9基因編輯方法的療法ABO-301(AAV-FANCC)用于治療范可尼貧血,但目前在該公司的研發管線中并未看到ABO-301的研究進展,其他渠道也未查到相關信息。
 ▲圖片來源:Abeona官方網站
▲圖片來源:Abeona官方網站
國內研究范可尼貧血進入臨床階段的是深圳市免疫基因治療研究院,目前正在招募志愿者中,這也該研究院基因治療血液遺傳疾病的第三個研究方向。
 ▲圖片來源:深圳市免疫基因治療研究院官方網站
▲圖片來源:深圳市免疫基因治療研究院官方網站
基因療法除能用于治療血友病、地中海貧血、鐮狀細胞病及范可尼貧血等遺傳性血液疾病外,也有研究者利用基因技術治療血液腫瘤。
致力于異體CAR-T療法開發的法國生物公司Cellectis開發了一款用于治療急性髓系白血病(Acute myeloid leukemia,AML)的UCART123,該療法通過TALEN技術基因編輯異體T細胞,使之特異性靶向AML和母細胞性漿細胞樣樹突狀細胞腫瘤(Blastic Plasmacytoid Dendritic CellNeoplasm,BPDCN)細胞表面的CD123抗原而發揮作用。2017年2月,UCART123獲得美國FDA的IND批準,用于治療成為第一款由FDA批準進入臨床試驗的此類產品,但UCART123后續的臨床試驗并不順利。同年9月,臨床試驗中便出現了一個BPDCN的患者死亡事件,隨后就被FDA叫停,并要求Cellectis在安全性上重新設計,2個月后FDA才恢復該療法的臨床試驗,根據clinicaltrials.gov顯示,目前該療法仍處于1期臨床試驗階段。
 ▲圖片來源:Cellectis官方網站
▲圖片來源:Cellectis官方網站
不僅是Cellectis公司,Precision BioSciences/施維雅也開發了CD19導向、同種異體嵌合抗原受體T細胞療法(CAR-T)PBCAR0191,用來治療晚期B細胞前體急性淋巴細胞白血病(B-ALL)。Precision通過其專有的ARCUS?基因組編輯平臺在體外對T細胞進行修飾,在T細胞受體(TCR)位點插入CAR基因并同時敲除TCR,進行體外擴增后再回輸至患者體內以達到治療目的。基于該平臺技術,Precision也構建了包括多個通用型CAR-T免疫細胞療法和數個體內基因校正療法的管線。2019年3月,PBCAR0191正式開啟了1期臨床試驗,適應癥包括B-ALL和非霍奇金淋巴瘤,根據clinicaltrials.gov顯示,目前該療法處于1/2期臨床試驗階段。
 ▲圖片來源:Precision官方網站
▲圖片來源:Precision官方網站
除上述Biotech之外,越來越多的大型制藥公司正在積極投入到基因療法的布局中,通過并購、合作開發等方式介入這一領域,獲得強勁的競爭力量。像文中提到的輝瑞、賽諾菲、諾華等公司就在血友病、地中海貧血等血液疾病領域與基因治療公司合作開發。
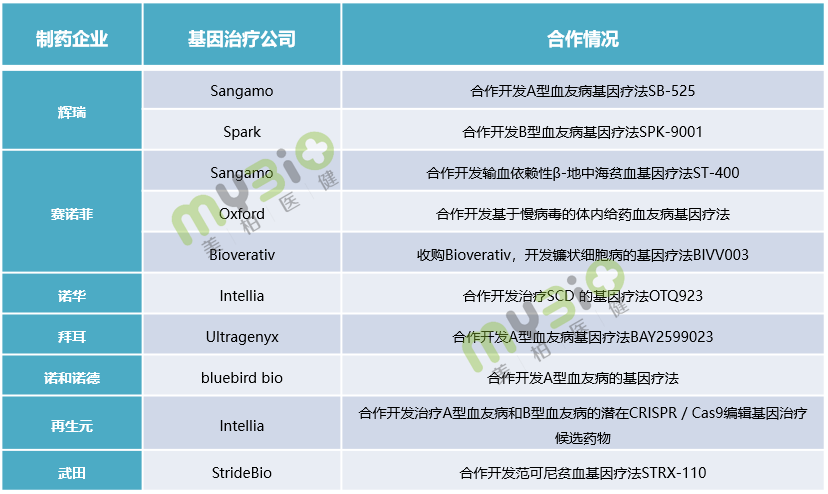 ▲表5 部分大型制藥企業在血液遺傳病領域的合作情況
▲表5 部分大型制藥企業在血液遺傳病領域的合作情況
綜合來看,國外的基因治療行業大步向前,國內的企業也在快速追趕。就本篇內容分析,全球開展基因治療血液遺傳疾病臨床試驗研究最多的國家是美國,大概占比65%,中國也在積極開展,占比近20%,其他國家如英國、意大利、西班牙、法國等也在進行血液疾病的臨床研究,但與美國和中國相比還是較為落后;并且,這些研究與開發血液遺傳病基因療法的企業一半也是注冊在美國,還有約三分之一是中國企業,我國的基因行業正逐漸興起。目前,美國的基因治療進展仍穩居首位,我國雖緊隨其后,但也有一定的距離,這有可能是長久以來,兩國在生物領域這一大板塊上科研和技術的水平、臨床治療經驗的積累以及政策監管的實施和投入等多方面差距導致的。
在血液遺傳病的基因治療領域,僅有治療β 地中海貧血的Zynteglo獲EMA批準有條件上市,其他進展較快的、有希望緊隨其后上市的屬適應癥為SCD的Zynteglo(β 地中海貧血獲批)、BioMairn的BMN270、Sangamo/輝瑞的SB-525,這些產品均處于3期臨床試驗階段。國內基因治療領域的研究雖在數目上比較樂觀,但臨床研究基本處在臨床前或1期臨床試驗階段,不過國內的監管部門也隨著這一技術的快速發展而不斷出臺新的相關政策,以更加規范、全面的實施監管。基因療法也許會成為中國實現彎道超車,拉近與國外生物技術水平距離的機會。在2020年10月,我國也迎來了首個CRISPR基因編輯療法臨床試驗申請,這一里程碑事件也會激勵著越來越多國內新興技術的企業取得革命性的突破。
基因療法能夠從“根本”去解決問題,所以,該治療方案被認為有望治愈傳統藥物不能解決的疾病。對于如血友病、地中海貧血、鐮狀細胞病等的血液遺傳疾病,基因療法是較為理想治療方案,通過改造缺陷基因達到徹底治愈疾病的目的;其他比較熱門的適應癥還包括遺傳性眼部疾病如遺傳性視網膜疾病、遺傳性視神經病變等。隨著技術的進步,基因療法將會在越來越多的適應癥上展現良好的治療效果,我們應持續關注該領域的發展。